自上個(gè)世紀(jì)下葉被發(fā)現(xiàn)以來(lái)�,紫杉醇(Paclitaxel�����,PTX)就一直是化療界的明星���。因?yàn)槠涓叨瓤拱┗钚?���,紫杉醇目前已?jīng)被廣泛應(yīng)用于卵巢癌、乳腺癌���、肺癌等多種癌癥的一線治療[1]�。奇點(diǎn)糕還記得曾經(jīng)有過(guò)新聞��,紫杉醇的原料紅豆杉被百姓剝了樹皮泡酒����,引為抗癌“神藥”(當(dāng)然了,這是個(gè)錯(cuò)誤的做法�,直接服用紅豆杉可是會(huì)中毒的)。
不過(guò)��,紫杉醇的作用也是把雙刃劍��,在利用細(xì)胞毒性殺死癌細(xì)胞的同時(shí)��,它也會(huì)增加癌細(xì)胞對(duì)化療劑的抗性并促進(jìn)癌細(xì)胞轉(zhuǎn)移���。在8月份的《美國(guó)國(guó)家科學(xué)院院刊》(PNAS)上����,來(lái)自俄亥俄州立大學(xué)生物化學(xué)與藥理學(xué)教授Tsonwin Hai團(tuán)隊(duì)的一項(xiàng)研究為紫杉醇促進(jìn)乳腺癌的肺轉(zhuǎn)移[2]提供了“實(shí)錘”。

Tsonwin Hai教授
研究結(jié)果揭示了兩個(gè)主要的機(jī)制:一是紫杉醇會(huì)改變?cè)l(fā)腫瘤周邊血管的狀態(tài)���,幫助乳腺癌細(xì)胞進(jìn)入血循環(huán)����;二是它還會(huì)在肺組織中“辛勤耕耘”����,使肺組織微環(huán)境更適合癌細(xì)胞生存,促進(jìn)癌細(xì)胞“生根發(fā)芽”�����。而這些有害影響����,都要通過(guò)一個(gè)名為Atf3的基因來(lái)實(shí)現(xiàn)�����。
Atf3是一種應(yīng)激快反應(yīng)基因��,正常情況下表達(dá)量非常低�����,當(dāng)受到外界信號(hào)刺激,就會(huì)快速大量表達(dá)�。表達(dá)產(chǎn)物Atf3蛋白是一種轉(zhuǎn)錄因子,能夠直接或間接調(diào)控很多參與炎癥反應(yīng)的基因的表達(dá)[3]���。
那么究竟科學(xué)家是怎么證實(shí)紫杉醇的“叛變”行為的呢�����?
Hai教授和她的團(tuán)隊(duì)在小鼠身上進(jìn)行了試驗(yàn)����。他們對(duì)能夠發(fā)生自發(fā)轉(zhuǎn)移的乳腺癌模型小鼠注射了一定量的紫杉醇�����。比起對(duì)照組��,注射了紫杉醇的實(shí)驗(yàn)組小鼠原發(fā)腫瘤確實(shí)有縮小��,但是轉(zhuǎn)移到肺部的癌細(xì)胞卻更多�����!研究者對(duì)敲除了Atf3基因的小鼠也做了同樣的實(shí)驗(yàn),結(jié)果卻并沒(méi)有什么差別�。這足以說(shuō)明紫杉醇的這種促進(jìn)癌癥轉(zhuǎn)移的作用與Atf3基因有關(guān)了。
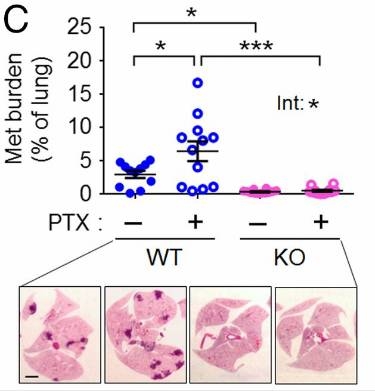
上:在第26天�����,不使用紫杉醇治療和使用紫杉醇治療以及敲除Atf3基因后不使用紫杉醇治療和使用紫杉醇治療的四種小鼠肺轉(zhuǎn)移腫瘤占總肺部的面積
下:四種小鼠的肺部切片�,深色部分為轉(zhuǎn)移瘤
為了搞清除紫杉醇和Atf3基因到底是怎么使壞的,研究人員對(duì)這幾種腫瘤組織進(jìn)行了檢測(cè)�����,發(fā)現(xiàn)用紫杉醇治療的小鼠腫瘤組織中微血管的密度特別高����,而且一些能幫助腫瘤轉(zhuǎn)移和新血管生成的細(xì)胞(表達(dá)Tie2基因的單核巨噬細(xì)胞��,TEMs)也增加了�。他們還發(fā)現(xiàn),和血管生成有關(guān)的一些基因表達(dá)量高(如Ang1�����,Notch1和Cxcl1)�,和抗血管生成有關(guān)的一些基因表達(dá)量低(如Cxcl9、10、11和14)����。
另外,還有一個(gè)有意思的現(xiàn)象�����,乳腺癌細(xì)胞擴(kuò)散需要通過(guò)三種細(xì)胞的直接接觸——內(nèi)皮細(xì)胞�����、血管周圍巨噬細(xì)胞和增強(qiáng)癌細(xì)胞擴(kuò)散能力的Mena蛋白水平高的癌細(xì)胞����。過(guò)去的研究發(fā)現(xiàn),這三種細(xì)胞在哪里接觸�,癌細(xì)胞就在哪里進(jìn)入血管,后來(lái)����,這個(gè)“位點(diǎn)”被命名為腫瘤轉(zhuǎn)移微環(huán)境(tumor microenvironment of metastasis,TMEM)[4]�。
所以,TMEM就相當(dāng)于一扇門��,當(dāng)“三把鑰匙”聚齊時(shí),癌細(xì)胞就可以打開門����,進(jìn)入血管中了。在這次的研究中�����,研究人員也發(fā)現(xiàn)�,使用紫杉醇治療的小鼠TMEM密度明顯升高,這也說(shuō)明�,紫杉醇為癌細(xì)胞多造了幾扇門,幫助了它向肺部轉(zhuǎn)移��。這和不久前發(fā)表在《科學(xué)轉(zhuǎn)化醫(yī)學(xué)》上的另一項(xiàng)研究“不謀而合”����,他們?cè)诨煹陌┌Y患者身上也發(fā)現(xiàn)了這個(gè)現(xiàn)象[5]。
所以這幾項(xiàng)指標(biāo)的變化意味著����,紫杉醇不光給癌細(xì)胞開拓了更多的“出走路線(微血管)”���,還幫它們打開了脫離桎梏的“大門(TMEM)”����。
以上這些結(jié)果都只出現(xiàn)在野生型小鼠上,敲除了Atf3基因的小鼠實(shí)驗(yàn)組和對(duì)照組沒(méi)有明顯差異�����。這說(shuō)明����,紫杉醇的使用促進(jìn)血管生長(zhǎng)、增加癌細(xì)胞轉(zhuǎn)移微環(huán)境��,這些影響都是通過(guò)Atf3基因?qū)崿F(xiàn)的����。
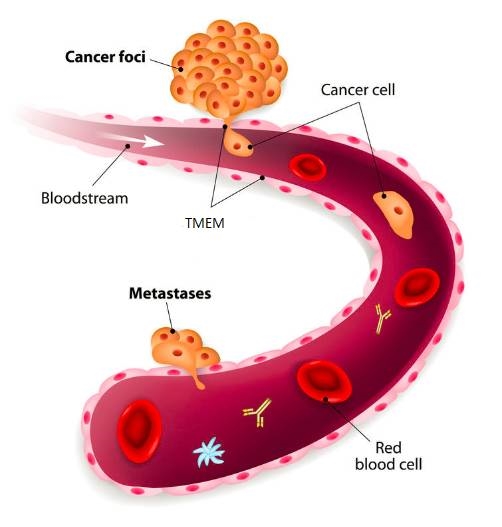
癌細(xì)胞通過(guò)TMEM進(jìn)入血管
只關(guān)注原發(fā)腫瘤還不夠,研究人員又盯上了癌細(xì)胞轉(zhuǎn)移的目標(biāo)組織——肺部�����。他們給用紫杉醇預(yù)處理過(guò)的小鼠靜脈注射癌細(xì)胞�,最大程度地消除了紫杉醇對(duì)癌細(xì)胞的直接殺傷影響。
結(jié)果顯示��,注射過(guò)紫杉醇的實(shí)驗(yàn)組肺組織比對(duì)照組有更多的癌細(xì)胞定殖����。對(duì)肺組織的檢測(cè)發(fā)現(xiàn)���,實(shí)驗(yàn)組中穿孔素(Prf1)表達(dá)下調(diào),炎癥性單核細(xì)胞(iMs)數(shù)量上升�,趨化因子配體2(CCL2)表達(dá)上調(diào)。
Prf1是重要的溶菌蛋白之一��,存在于細(xì)胞毒性T細(xì)胞和天然殺傷(NK)細(xì)胞中�,有抑癌作用[6];iMs可以進(jìn)入肺中分化成巨噬細(xì)胞���,促進(jìn)腫瘤轉(zhuǎn)移[7]�����;而CCL2是一種小分子蛋白����,可以促進(jìn)炎癥性單核細(xì)胞富集��,增強(qiáng)炎癥反應(yīng)��,對(duì)腫瘤發(fā)展起著重要作用[8]���。
同樣�����,這些結(jié)果也只出現(xiàn)在野生型小鼠上��。這說(shuō)明�����,紫杉醇的使用改變了肺組織的微環(huán)境�����,使癌細(xì)胞更容易在肺組織上定殖�����,這些影響也是通過(guò)Atf3基因?qū)崿F(xiàn)的����。
那么現(xiàn)在我們可以確定了����,紫杉醇一方面促使腫瘤細(xì)胞從原發(fā)腫瘤逃離�����,一方面改變肺部微環(huán)境使之更適合腫瘤細(xì)胞定殖���,而Atf3基因在其中起關(guān)鍵作用。
紫杉醇(PTX)對(duì)原發(fā)腫瘤和轉(zhuǎn)移組織的影響
要不是看到這些證據(jù)���,奇點(diǎn)糕真是不愿意相信��,紫杉醇竟然助紂為虐��!不過(guò)����,這些在小鼠身上得到的實(shí)驗(yàn)結(jié)果���,是否適用于人類呢����?
研究者們自然也考慮到了這一點(diǎn)�。為了證實(shí)小鼠數(shù)據(jù)與人類癌癥的相關(guān)性,他們從公開的腫瘤數(shù)據(jù)庫(kù)[9]中的樣本數(shù)據(jù)進(jìn)行了分析。結(jié)果不出所料�����,在接受了化療的乳腺癌患者的腫瘤組織中��,Atf3真的有更高的表達(dá)�����。相應(yīng)的����,患者也出現(xiàn)了高水平的CCL2����、CCL7、CCL8等炎癥指標(biāo)以及低水平的Prf1��、NK細(xì)胞和細(xì)胞毒性T細(xì)胞等�����。
在乳腺癌�、肺癌、卵巢癌和結(jié)腸癌中,ATF3基因和TEK基因高表達(dá)(紅)和低表達(dá)(綠)對(duì)患者生存率的影響
這些分析結(jié)果與小鼠試驗(yàn)的表征是一致的��,可見(jiàn)小鼠試驗(yàn)結(jié)果的確能揭示紫杉醇在人體癌癥轉(zhuǎn)移中起到的作用�。
研究人員還使用其他株系的癌細(xì)胞替換了他們?cè)谶@次實(shí)驗(yàn)中所用的乳腺癌細(xì)胞,還嘗試用其他化療藥物如環(huán)磷酰胺(CTX)替換紫杉醇�,甚至還使用不同種系的小鼠進(jìn)行了實(shí)驗(yàn),結(jié)果無(wú)一例外�����。Atf3基因介導(dǎo)的化療劑對(duì)癌癥肺轉(zhuǎn)移的促進(jìn)作用不局限于單一化療藥物����、單個(gè)癌種或單個(gè)試驗(yàn)對(duì)象,這是一種在化療中普遍存在的現(xiàn)象��。
鑒于早先有研究表明����,全身化療后殘留的腫瘤與臨床上的不良預(yù)后有關(guān)[10],那么���,這個(gè)研究可以說(shuō)是對(duì)今后化療的使用很有臨床意義了��。Hai教授表示�����,或許將來(lái)可以通過(guò)抑制Atf3基因的表達(dá)來(lái)解除化療的這個(gè)副作用�����,這也是他們的下一個(gè)研究目標(biāo)�。
不過(guò)這個(gè)研究也存在一些局限性:對(duì)小鼠的整體研究沒(méi)有辦法確定在不同類型細(xì)胞中Atf3基因的作用����;而且除了血管轉(zhuǎn)移途徑之外,癌細(xì)胞也可以通過(guò)淋巴管轉(zhuǎn)移�����,Atf3基因?qū)@條路線的影響還未可知等等�。
“研究者應(yīng)當(dāng)隨時(shí)保持一個(gè)開闊的眼界。”Hai教授在一次采訪中如是說(shuō)[11]���。奇點(diǎn)糕想�����,科學(xué)或許就是在對(duì)前人的顛覆上不斷前行����、不斷進(jìn)步的吧。
參考資料:
[1] "Paclitaxel". The American Society of Health-System Pharmacists. Retrieved January 2, 2015.
[2] Yi Seok Chang, Swati P. Jalgaonkar, Justin D. Middleton, Tsonwin Hai.Proceedings of the National Academy of Sciences, 2017; 201700455 DOI: 10.1073/pnas.1700455114.
[3] Corradini P, Ladetto M, Pileri A, Tarella C (1999) Clinical relevance of minimal residual disease monitoring in non-Hodgkin’s lymphomas: A critical reappraisal of molecular strategies. Leukemia 13:1691–1695.
[4] Harney AS, et al. (2015) Real-time imaging reveals local, transient vascular permeability, and tumor cell intravasation stimulated by TIE2hi macrophage-derived VEGFA. Cancer Discov 5:932–943.
[5] George S. Karagiannis, Jessica M. Pastoriza, Yarong Wang et al. Neoadjuvant chemotherapy induces breast cancer metastasis through a TMEM-mediated mechanism. Science Translational Medicine, 05 Jul 2017, 9(397):eaan0026, doi:10.1126/scitranslmed.aan0026.
[6] Barry M, Bleackley RC (2002) Cytotoxic T lymphocytes: All roads lead to death. Nat Rev Immunol 2:401–409.
[7] Qian BZ, et al. (2011) CCL2 recruits inflammatory monocytes to facilitate breasttumour metastasis. Nature 475:222–225.
[8] Qian B, et al. (2009) A distinct macrophage population mediates metastatic breast
cancer cell extravasation, establishment and growth. PLoS One 4:e6562.
[9] Boersma BJ, et al. (2008) A stromal gene signature associated with inflammatory breast cancer. Int J Cancer 122:1324–1332.
[10] Symmans WF, et al. (2017) Long-term prognostic risk after neoadjuvant chemotherapy associated with residual cancer burden and breast cancer subtype. J Clin Oncol 35: 1049–1060.
[11] https://www.sciencedaily.com/releases/2017/08/170807155401.html