近日�,來自全球十大科研機構(gòu)之一魏茲曼研究所的Ravid Straussman教授及其領導的團隊聯(lián)合哈佛大學、麻省理工學院����、劍橋大學等機構(gòu)的研究者共同發(fā)現(xiàn),胰腺癌組織內(nèi)存在細菌��,而且這些細菌居然還一味地護著腫瘤���,不但不招來免疫細胞誅殺癌細胞�,反而助紂為虐地幫助癌組織「吃掉」常用化療藥物吉西他濱�����。只要特定微生物是癌細胞的座上賓,研究人員使用10倍于正常濃度的吉西他濱����,也傷不得癌細胞分毫。Straussman教授團隊的這一重要發(fā)現(xiàn)刊登在頂級期刊《科學》雜志上[1]�����。

Ravid Straussman教授
胰腺癌�����,其自身可分泌胰蛋白酶分解組織促進轉(zhuǎn)移�����,又因胰腺的解剖部位較為隱蔽�,許多胰腺癌患者確診時已屬晚期,故預后極差��,中位生存期只有3-6個月�����,5年生存率在5%以下[2,3]�����。
作為胰腺癌治療的金標準�����,在吉西他濱(核苷酸類似物)問世以后改善了胰腺癌治療的有效率��,提高了患者的生存質(zhì)量����,但是���,應用十幾年來����,大部分胰腺癌患者仍會表現(xiàn)出對吉西他濱的耐藥�����,最終導致治療失敗[4]��。胰腺癌對于吉西他濱耐藥的機制�,一直以來也是科學家和臨床工作者研究的重點�����。
研究人員曾經(jīng)認為���,腫瘤周圍的非癌組織會分泌一些物質(zhì),保護腫瘤組織不受藥物的傷害��,例如腫瘤周圍的成纖維細胞分泌的肝細胞生長因子(HGF)等[5,6]�����。
2012年���,Straussman教授團隊也想研究健康組織對胰腺癌耐吉西他濱的影響�。于是他們找了一大堆健康的組織��,與胰腺癌細胞一起培養(yǎng)���,再使用吉西他濱處理�,看看哪種組織會幫胰腺癌擋子彈��。
出乎意料的是,他們發(fā)現(xiàn)一塊兒來自某個女性的皮膚組織��,似乎有超乎尋常的神力�。當這個皮膚細胞的細胞株與胰腺癌細胞一起培養(yǎng)的時候,使用10倍于正常劑量的吉西他濱也傷不到胰腺癌細胞����。而且��,這個皮膚細胞株的培養(yǎng)液也具備這種功能����。研究人員當時的第一想法是,也許是細胞分泌某種物質(zhì)幫了胰腺癌細胞大忙�����。
后來他們花了數(shù)年時間��,試圖找到那個關(guān)鍵的物質(zhì)����,但是一直無所獲。就在僵持不下的時候���,Straussman教授的學生���,本研究的共同第一作者Leore Geller意外發(fā)現(xiàn)�����,在使用直徑為0.45um過濾器過濾皮膚細胞的培養(yǎng)液之后����,皮膚細胞培養(yǎng)液對胰腺癌細胞的保護作用喪失了����。
這個神奇的現(xiàn)象讓Geller意識到,助紂為虐的極有可能是細菌��,因為0.45um的孔徑足以過濾掉培養(yǎng)液中幾乎所有細菌��。結(jié)果他們真的在皮膚細胞中分離到一種類似細菌但不具有細胞壁的原核微生物——豬鼻支原體(Mycoplasma hyorhinis)�����。
當他們在皮膚細胞培養(yǎng)基中加適量的抗生素之后�����,神奇的保護作用也消失了。如果把豬鼻支原體注射到小鼠的腫瘤里�����,這個腫瘤就對吉西他濱產(chǎn)生了耐藥性��。
如此看來����,極有可能是豬鼻支原體在作怪。但是豬鼻支原體究竟從哪里來的呢����?讓人氣餒的是���,研究人員發(fā)現(xiàn)�����,皮膚細胞中的豬鼻支原體實際上是因早期污染而進入皮膚組織內(nèi)的����。
「看到這個結(jié)果����,我們真想把實驗材料都扔了��?��!筍traussman教授表示,「但是�,我們后來還是決定跟隨這個偶然的發(fā)現(xiàn),繼續(xù)前行�。」[7]

2014年�����,比利時的研究團隊曾經(jīng)在他們的研究中發(fā)現(xiàn)�����,感染了豬鼻支原體的腫瘤組織培養(yǎng)物對吉西他濱不敏感[8]���,這可能與豬鼻支原體體內(nèi)的胞嘧啶核苷脫氨酶(cytidine deaminase�,CDD)有關(guān)����。于是Straussman團隊猜測���,除了感染的豬鼻支原體,腫瘤內(nèi)可能有其他可以產(chǎn)生CDD的細菌�����。
于是他們找到了一個叫KEGG的數(shù)據(jù)庫[9]�,分析了2674種細菌的數(shù)據(jù)信息,發(fā)現(xiàn)11.4%的細菌攜帶有長鏈的CDD���,44.4%的細菌攜帶有短鏈的CDD�����,剩下的細菌沒有完整的CDD。其中�,98.4%的含長鏈CCD的細菌屬于γ-變形菌綱,例如大名鼎鼎的大腸桿菌和假單胞菌等�。
經(jīng)過進一步的分析,研究人員發(fā)現(xiàn)����,具有長鏈CDD的細菌才具備讓吉西他濱代謝失活的功能。于是他們用大腸桿菌進一步驗證他們的發(fā)現(xiàn)���。
結(jié)果在他們的意料之中��,長鏈CDD缺失的大腸桿菌會失去代謝吉西他濱的能力����,而補充長鏈的CDD后這種作用又可以重新恢復。同時研究人員還發(fā)現(xiàn)�����,吉西他濱只有進入到大腸桿菌體內(nèi)�,才能被代謝掉。這也直接解釋了前面的濾液不起作用的原因�����。也證實了吉西他濱是被細菌吃掉了�。而且他們還在小鼠模型體內(nèi)證明了大腸桿菌的這種功能。
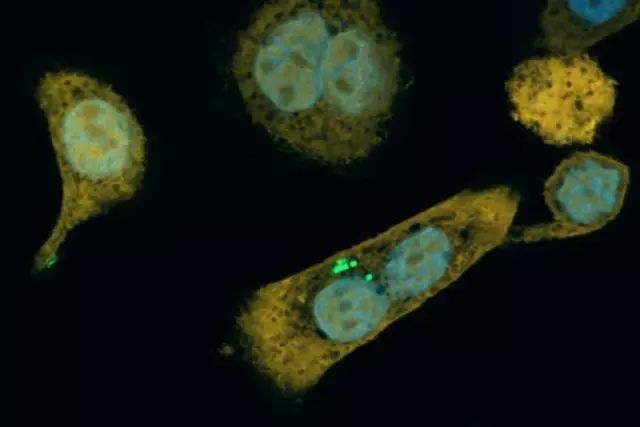
胰腺腫瘤內(nèi)部的細菌
為了確定人體的胰腺腫瘤內(nèi)是否確實有類似的細菌�����,研究人員檢測了113個胰腺癌患者以及20個正常人的胰腺組織的細菌DNA���、RNA以及脂多糖發(fā)現(xiàn)�,76%(86/113)的胰腺癌細胞中存在細菌,而正常胰腺細胞中只有15%(3/20)存在細菌����。而且在胰腺腫瘤里面的細菌,絕大部分屬于γ-變形菌綱�。即,它們都有「消化」吉西他濱的長鏈CDD��。
當研究人員將從人體胰腺腫瘤中分離的15個菌株分別與癌細胞一起培養(yǎng)時���,他們發(fā)現(xiàn)�����,其中14個菌株可以幫助癌細胞產(chǎn)生吉西他濱抗性��。這也再次證明����,人體胰腺癌腫瘤內(nèi)也是有這種中和吉西他濱毒性的微生物的�。
「這個研究的意義不僅僅在于胰腺癌�,也不僅僅在于吉西他濱?����!筍traussman教授說,「我們之前對腫瘤內(nèi)的細菌知之甚少����,這個研究會擴大我們對腫瘤的認識?��!?/p>
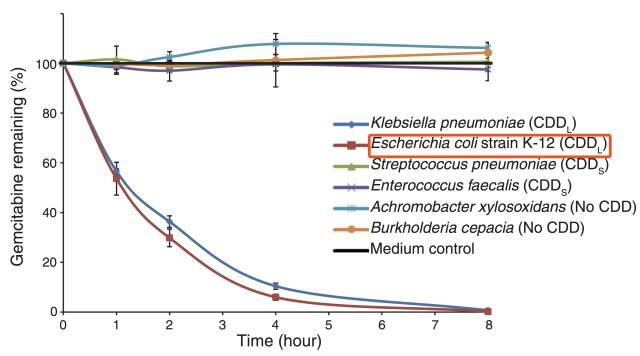
大腸桿菌K-12可在8小時內(nèi)「吃掉」所有化療藥物
畢竟吉西他濱已被批準用于胰腺癌�����、非小細胞肺癌和乳腺癌等多種實體腫瘤的治療����,這些腫瘤也存在耐藥性�。而對于胰腺腫瘤內(nèi)細菌的來源,研究人員表示有兩種途徑:第一���,胰腺與腸道是相通的�����,所以原本寄居在腸道內(nèi)的細菌����,極有可能沿著胰腺分泌物的通道逆流而上,進入胰腺�;第二,實際上細菌無時無刻不在通過口腔���、腸道等部位進入我們的血液��,大部分細菌都會被免疫細胞消滅掉�,但是它們一旦進入腫瘤內(nèi)��,人體免疫系統(tǒng)也就拿它們沒轍了[10]��。
既然腫瘤的耐藥性與細菌有關(guān)�,而且研究表明,使用抗生素可以解除腫瘤的耐藥性���。那是不是意味著可以使用抗生素輔助治療呢���?在Straussman看來,直接使用抗生素不是一個好選擇�����?��?股責o差別地殺傷所有細菌���,會導致對人體有益的微生物也不幸被消滅掉。研究人員認為����,最好的辦法是開發(fā)靶向長鏈CDD的藥物,只要讓這個酶失活����,化療藥物的活性就可以保持了。
大約在一個月前�����,來自上海交通大學醫(yī)學院附屬仁濟醫(yī)院消化科的房靜遠教授�����、陳縈晅副教授���、洪潔和陳豪燕副研究員以及美國密西根大學鄒偉平教授合作�,在頂級期刊《細胞》上發(fā)表微生物導致腸癌耐藥的重要研究成果,他們首次從證明具核梭桿菌(Fusobacterium nucleatum)可以通過調(diào)節(jié)癌細胞的自噬作用��,促進結(jié)直腸癌對化療的耐受[11]��。
不過發(fā)現(xiàn)癌組織內(nèi)的細菌可以讓抗癌藥物失活�,還尚屬首次。目前研究團隊正在探索其他腫瘤內(nèi)是不是也存在類似的細菌���,以及它們對其他腫瘤耐藥性的影響�。
參考資料:
[1]Ravid Straussman et al��,Potential role of intratumor bacteria in mediating tumor resistance to the chemotherapeutic drug gemcitabine.Science 357, 1156–1160 (2017)
[2] Lin QJ et al, Current status and progress of pancreatic cancer in China. World J Gastroenterol. 2015 Jul 14;21(26):7988-8003. doi:10.3748/wjg.v21.i26.7988. Review. PubMed PMID: 26185370; PubMed Central PMCID:PMC4499341.
[3] 戴月娣,張德祥,袁蘇徐,陶莉.胰腺癌治療方式評價及預后分析[J].中國癌癥雜志,2011,21(03):211-215.
[4] 梁晨,王瑧,李影奕. 低表達miR-33a誘導胰腺癌細胞對吉西他濱的耐藥[J]. 中國癌癥雜志,2015,25(02):87-94.
[5]Straussman R et al, Tumour micro-environment elicits innate resistance to RAF inhibitors through HGF secretion. Nature. 2012 Jul 26;487(7408):500-4. doi: 10.1038/nature11183. PubMed PMID: 22763439; PubMed Central PMCID: PMC3711467.
[6]Wilson TR et al, Widespread potential for growth-factor-driven resistance to anticancer kinase inhibitors. Nature. 2012 Jul 26;487(7408):505-9. doi: 10.1038/nature11249. PubMed PMID: 22763448; PubMed Central PMCID: PMC3724525.
[7] https://wis-wander.weizmann.ac.il/life-sciences/how-bacteria-hinder-chemotherapy
[8]J. Vande Voorde et al.,Nucleoside-catabolizing Enzymes in Mycoplasma-infected Tumor Cell Cultures Compromise the Cytostatic Activity of the Anticancer Drug Gemcitabine. J. Biol. Chem. 289, 13054–13065 (2014).
[9]Kanehisa M, et al, KEGG: kyoto encyclopedia of genes and genomes. Nucleic Acids Res. 2000 Jan 1;28(1):27-30. PubMed PMID: 10592173; PubMed Central PMCID:PMC102409
[10]https://www.theatlantic.com/science/archive/2017/09/how-bacteria-could-protect-tumors-from-anticancer-drugs/539670/
[11]Yu T C, Guo F, Yu Y, et al. Fusobacterium nucleatum Promotes Chemoresistance to Colorectal Cancer by Modulating Autophagy[J]. Cell, 2017, 170(3): 548-563. e16.