理論上干細(xì)胞技術(shù)是徹底治療許多疾病的終極手段,因為干細(xì)胞能分化成所有的組織細(xì)胞��,能作為更新替換損傷和丟失的細(xì)胞,但是目前干細(xì)胞技術(shù)距離最終臨床應(yīng)用仍然有一定距離�。關(guān)鍵是干細(xì)胞使用方法,干細(xì)胞的安全性等問題沒有有效解決��。最近《自然》對炎癥性腸病細(xì)胞治療進(jìn)行了介紹����。
炎癥性腸病包括潰瘍性結(jié)腸炎和克羅恩病,雖然有多種治療方法���,如經(jīng)典的抗炎藥物����、糖皮質(zhì)激素和最新的生物藥物��,但是人們對引起該疾病復(fù)雜的基因�����、表觀遺傳和環(huán)境因素等多層次因素并沒有全面理解���,也無法建立理想的動物模型��。這種疾病目前無法被治愈���,其中對有些患者所有治療方法都沒有作用�����。
皇家倫敦醫(yī)院青少年和成人炎癥性腸病主管詹姆斯·林賽說,有許多患者遭受這一疾病的折磨����,但無法獲得最新治療技術(shù)。一些頑固性結(jié)腸炎患者有的失業(yè)在家���,有的住院�,接受靜脈營養(yǎng)和激素維持治療����,難以具有基本的生活質(zhì)量。
目前該疾病治療的研究已經(jīng)進(jìn)入到細(xì)胞治療領(lǐng)域��。細(xì)胞治療有三種應(yīng)用��,最主要的是采用造血干細(xì)胞移植�,成體干細(xì)胞具有分化成多種細(xì)胞類型的潛力。從研究方法上���,科學(xué)家利用體外三維細(xì)胞培養(yǎng)技術(shù)�����,用人類腸道干細(xì)胞人工培養(yǎng)成腸道組織����。也有使用免疫細(xì)胞調(diào)節(jié)免疫功能的治療策略。經(jīng)過多年的探索��,有一些細(xì)胞治療技術(shù)已經(jīng)進(jìn)入臨床試驗階段��,雖然距離臨床應(yīng)用仍然需要很長時間�,但這已經(jīng)給哪些無藥可用的炎癥性腸病患者提供了希望。
一�����、造血干細(xì)胞
存在骨髓中的造血干細(xì)胞能分化成各種血液細(xì)胞�����,包括具有免疫功能的白細(xì)胞��。多年前��,臨床上就使用造血干細(xì)胞移植治療白血病,基本原理就是用正常人的造血干細(xì)胞替換患者癌變的造血干細(xì)胞�,基本技術(shù)就是用放射線或藥物將患者自身異常的造血干細(xì)胞全部殺死,然后給患者移植捐助者正常的造血干細(xì)胞��。
造血干細(xì)胞移植也能重建免疫系統(tǒng)���,對多發(fā)性硬化等自身免疫性疾病具有治療效果�����。1990 年代,胃腸學(xué)家開始注意到一些克羅恩病患者接受了干細(xì)胞移植治療后結(jié)腸炎癥癥狀明顯緩解���。盡管這些現(xiàn)象引起使用細(xì)胞移植治療的興趣���,但是人們對這種治療的存在致命危險依然擔(dān)憂。林賽說���,權(quán)衡這種致命療法和獲得未知效應(yīng)之間顯然會讓人擔(dān)心�。
自身干細(xì)胞移植試驗讓這種擔(dān)心有了更具體的證據(jù)����。自身干細(xì)胞移植治療克羅恩病臨床試驗 (ASTIC) 已經(jīng)進(jìn)入三期�����,這種治療方法和血液病造血干細(xì)胞移植類似����,唯一不同的是捐獻(xiàn)干細(xì)胞不是其它人��,而是患者自己�����。對患者自身的干細(xì)胞進(jìn)行體外培養(yǎng)后重新移植給患者�����。ASTIC 有 11 個歐洲中心參加����,共招募了 45 名頑固性克羅恩病患者參加試驗。試驗第一年 23 名志愿者接受了移植��,然后接受標(biāo)準(zhǔn)治療��,另外 22 名只接受標(biāo)準(zhǔn)治療(C. J. Hawkeyet al. J. Am. Med. Assoc. 314, 2524–2534; 2015)���。
ASTIC 首席科學(xué)家諾丁漢大學(xué)胃腸病學(xué)家克里斯托弗·霍基說��,我們的試驗希望回答兩個問題��,一是多長時間干細(xì)胞移植能治好克羅恩病�����,二是不進(jìn)行干細(xì)胞移植有多少人有治療效果�����。試驗主要終點比較困難�����,治療結(jié)束后 1 年內(nèi)持續(xù)臨床緩解����,治療效果需要用腸鏡排除活動性病變��,患者停止標(biāo)準(zhǔn)治療方法����?;艋f����,設(shè)置這樣高標(biāo)準(zhǔn)的研究目標(biāo)顯得不那么明智。按照這個高標(biāo)準(zhǔn)��,治療組只有 2 例達(dá)到有效�����,對照組只有 1 例���,而且治療帶來一系列嚴(yán)重副作用���,包括 1 名患者死亡。
考慮到達(dá)到終點的受試者數(shù)量少��,ASTIC 試驗結(jié)果是失敗的�,導(dǎo)致一些已經(jīng)注冊的試驗被叫停。但是霍基指出��,一些受試者確實獲得治療效果�。大約 50%的患者移植后 1 年內(nèi)沒有活動性克羅恩病癥狀,而對照組只有 25%。對受試者進(jìn)行 4 年的初步隨訪結(jié)果進(jìn)一步確認(rèn)了細(xì)胞移植的治療效果��。參與了這一試驗的林賽說�,治療改變了患者生活。例如一個過去需要依靠靜脈注射營養(yǎng)才能維持生命的患者��,經(jīng)過自身干細(xì)胞移植治療后�����,現(xiàn)在已經(jīng)擺脫靜脈營養(yǎng)��,并重新找到工作�����,雖然沒有完全康復(fù)�,但是生活質(zhì)量已經(jīng)發(fā)生了天翻地覆的改善。
但是治療失敗的研究結(jié)論讓哪些頑固性克羅恩病患者使用這種治療方法的患者失去機(jī)會�����。加州大學(xué)洛杉磯分校胃腸病學(xué)家和炎性腸道疾病中心主任 Daniel Hommes 說���。“細(xì)胞移植絕對可以說是這些患者的救命稻草。研究中奇怪的終點標(biāo)準(zhǔn)非常奇怪,并不能正確反映治療的作用�����。”
霍基和林賽等已經(jīng)提出一個新的細(xì)胞移植試驗,新試驗將采用毒性相對小的移植方案。林賽說��,我們不在追求殺死患者所有的癌細(xì)胞�。如果開始就選擇相對不苛刻的 FDA 對新生物技術(shù)要求的終點標(biāo)準(zhǔn),原來的試驗也是非常強(qiáng)的陽性結(jié)果��。
二����、間充質(zhì)干細(xì)胞
間充質(zhì)干細(xì)胞是多能成體干細(xì)胞���,能分化為骨, 軟骨, 肌肉和脂肪細(xì)胞�����。間充質(zhì)干細(xì)胞存在于骨髓����,也廣泛分布在于臍帶血�、牙髓和脂肪組織內(nèi)���。
Hommes 說,由于間充質(zhì)干細(xì)胞有明顯的損傷修復(fù)能力�,免疫原性小,應(yīng)用潛力廣泛�����,而受到廣泛重視���。間充質(zhì)干細(xì)胞用于腸病治療的最大規(guī)模成功的臨床試驗是局部注射治療肛門瘺管�。間充質(zhì)干細(xì)胞不僅可以修復(fù)損傷組織�,而且能下調(diào)炎癥,使傷口再生���。有很多證據(jù)證明這是一種有效的療法��。脂肪間充質(zhì)干細(xì)胞 III 期隨機(jī)臨床試驗治療克羅恩病肛門瘺管��,可以使 16% 的患者瘺管關(guān)閉(J.Panés et al. Lancet388, 1281–1290; 2016).����。在這些研究基礎(chǔ)上��,比利時生物技術(shù)公司 TiGenix 已經(jīng)向歐洲藥品局申請批準(zhǔn)將間充質(zhì)干細(xì)胞用于克羅恩病治療的臨床試驗��,希望在 2017 年下半年得到批準(zhǔn)�。
比利時魯汶大學(xué)醫(yī)院胃腸病學(xué)和肝臟病學(xué)家 Gert Van Assche 說,雖然治療有效�,但有效能達(dá)到什么程度仍然不知道。研究在很大程度上仍然是一個黑箱�,患者體內(nèi)發(fā)生具體什么變化很難觀察。我們不可能像實驗動物那樣隨意從患者體內(nèi)采集組織進(jìn)行檢測�。不得不使用動物實驗進(jìn)行驗證。
也有采用靜脈注射間充質(zhì)干細(xì)胞治療的嘗試��,但是大多數(shù)都失敗了����。Van Assche 認(rèn)為這比較容易理解,因為這些干細(xì)胞在達(dá)到損傷部位前就死去了��。
三�����、免疫調(diào)節(jié)細(xì)胞
人類免疫系統(tǒng)擁有多種類型的 T 淋巴細(xì)胞���,這些細(xì)胞具有各種功能��。調(diào)節(jié) T 細(xì)胞能阻斷其它炎癥 T 細(xì)胞引起的炎癥反應(yīng)����,在炎癥性腸病中發(fā)揮保護(hù)作用。
克羅恩病和 Treg 臨床研究 (CATS1) 是法國生物技術(shù)公司 TxCell 贊助的研究項目�。研究目的是驗證激活 Treg 對控制頑固性克羅恩病的效果(P. Desreumaux et al. Gastroenterology143, 1207–1217; 2012)。從 20 名受試者體內(nèi)分離 Treg����,用卵清蛋白激活,體外增殖后給患者回輸�����。當(dāng)這些患者吃含有卵清蛋白的酥皮蛋糕�����,這些 Treg 可以被激活�����,研究人員希望利用這種策略實現(xiàn)控制克羅恩病的炎癥����。
接受百萬個細(xì)胞的 8 名患者有 6 人在治療后 8 周癥狀明顯改善��,其中 2 名接近緩解。受到初步研究結(jié)果鼓勵��,公司進(jìn)一步增加研究規(guī)模����,招募了 56 名受試者。預(yù)計 2018 年獲得第一批研究結(jié)果��。Van Assche 認(rèn)為����,從基礎(chǔ)研究角度,免疫調(diào)節(jié)細(xì)胞有非常好的前景�,但是我們需要大規(guī)模臨床研究數(shù)據(jù)來確認(rèn)研究結(jié)論。
TxCell 目前正在尋找修飾 Treg 的技術(shù)����,目前是使用能產(chǎn)生表面蛋白的嵌合抗原受體工程 T 細(xì)胞,這種方法本來是用于癌癥免疫治療���。最新基因編輯技術(shù)的發(fā)展也給這種方法提供了方便���。Hommes 說����,Treg 工程細(xì)胞能靶向并阻斷啟動炎癥性腸病的特定免疫信號�����。但是這個技術(shù)首先需要確定參與疾病過程的特定信號�����。例如許多治療炎癥腸病的生物藥物是阻斷 TNF-α��,TNF-α本身并不是引起炎癥腸病特定分子���。
四���、類器官研究
科學(xué)家最近通過研究腸道干細(xì)胞尋找炎癥性腸病的治療方法,腸道干細(xì)胞是維持腸道健康的關(guān)鍵因素���。2009 年�����,荷蘭 Hubrecht 研究所分子遺傳學(xué)家 Hans Clevers 使用三維培養(yǎng)技術(shù)把腸道干細(xì)胞培養(yǎng)成三維組織模型�。這種研究仍然處于早期階段,但是這種類器官能變成誘導(dǎo)干細(xì)胞病能完全分化成成熟細(xì)胞����。
西奈醫(yī)療中心炎癥性腸病中心主任 Targan 說,他們已經(jīng)用來自炎癥性腸病患者的干細(xì)胞培養(yǎng)出腸道類器官����。當(dāng)這些患者干細(xì)胞被放置于三維培養(yǎng)基質(zhì)后����,這些細(xì)胞能分化成腸道結(jié)構(gòu)。研究人員用細(xì)菌或真菌感染這些類器官��,然后研究這些腸道細(xì)菌如何和免疫細(xì)胞相互作用�。科學(xué)家利用這種技術(shù)很快能獲得新禁止���,最終目標(biāo)是使用類器官作為疾病治療的移植材料����。
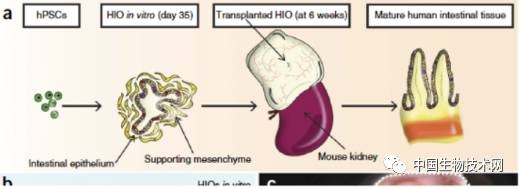
約翰霍普金斯大學(xué)小兒外科醫(yī)師 David Hackam 是用干細(xì)胞借助生物可降解支架制造人工小腸研究項目主任�,他希望這一技術(shù)將最終用于壞死性小腸結(jié)腸炎的治療。壞死性小腸結(jié)腸炎是一種罕見的早產(chǎn)兒疾病���,死亡率非常高��。這個技術(shù)的第一步是培養(yǎng)出手指樣腸絨毛��,腸黏膜是吸收葡萄糖����、脂肪酸和氨基酸分子的腸結(jié)構(gòu)。Hackam 和康奈爾大學(xué)生物工程師 John March 合作����,用膠原蛋白制作一個腸絨毛支架。然后是把小腸干細(xì)胞充填到這個絨毛���。用人類小腸干細(xì)胞制作的小腸絨毛已經(jīng)成功����,并被成功移植到小鼠體內(nèi)(S. A. Shaffiey et al. Regen. Med. 11,45–61; 2016)�����。研究小組下一步是進(jìn)一步優(yōu)化�����,并觀察是否具有吸收營養(yǎng)的基本功能。小腸蠕動和神經(jīng)支配功能也需要建立���。